eLife:最新调查破坏MYC与HCF
简介:HCF-1是MYC的关键辅助因子,破坏这种相互作用会促进体内肿瘤的快速和持续消退。
【红叶网探索分享】
MYC癌蛋白是大多数人类癌症的重要驱动力,每年造成近三分之一癌症相关的死亡。其能够同时充当转录激活因子和阻遏因子,通过与其他辅助因子互作结合,调节细胞周期和凋亡,蛋白质合成与代谢,基因组稳定性和血管生成。由于当前的医治和研究手段中难以靶标MYC,因此抑制其他蛋白质与MYC的互相作用被认为是当前新的抗癌疗法进展的方向。
近日,来自美国范德堡大学的研究人员在《eLife》上发表了题为MYC regulates ribosome biogenesis and mitochondrial gene expression programs through its interaction with host cell factor–1的研究成果,鉴定出HCF-1是MYC的关键辅助因子,二者互作的调控影响细胞的生长、氨基酸代谢、核糖体物种发生及线粒体功能,而破坏这种相互作用会促进体内肿瘤的快速和持续消退,可当作开拓新型抗MYC疗法的重点。

https://doi.org/10.7554/eLife.60191
宿主细胞因子HCF-1是细胞增殖过程中必需的染色质相关蛋白,可在未感染的细胞中当作细胞转录因子的辅助因子发挥作用。研究人员首先在MYC的HBM序列中引入许多突变对其与HCF-1的互作能力进行分析,发现在HBM序列4个残基均突变为丙氨酸(4A)后,MYC—HCF-1的相互作用被破坏了。

研究MYC与HCF-1相互作用的功能获得和丧失系统
那么互作能力的破坏对细胞会有什么影响呢?研究人员选择Burkitt淋巴瘤(bl)细胞进一步检测后,发现MYC–HCF-1的互作促进了培养中这些BL细胞的谷氨酰胺依赖性和快速增殖状态,而这也是单独的MYC所具有的能力;此外,由4A突变导致的MYC–HCF-1互作消逝也直接或间接的影响了细胞内天冬氨酸、谷氨酰胺等氨基酸水平的升高。
对MYC-HCF-1相互作用不同状态的细胞进行转录组分析后,研究人员发现4A突变导致了与核糖体物种发生,tRNA代谢和线粒体基质相关的基因表达下调,这也表明MYC-HCF-1互作可能在促进核糖体物种发生并维持线粒体功能的基因表达中起着主要作用。
ChIP-Seq对互作的直接转录靶标鉴定结果表明,BL细胞中染色质上的大多数HCF-1N结合位点也被MYC结合,重要位于与HCF-1相关的线粒体包膜、细胞周期以及核糖核蛋白复合物的物种发生等功能的基因启动子近端,且其中近三分之一基因表达受4A突变的影响。这也说明核糖体物种发生和线粒体连接的基因是MYC-HCF-1相互作用的直接靶点,受其互作的正调控。
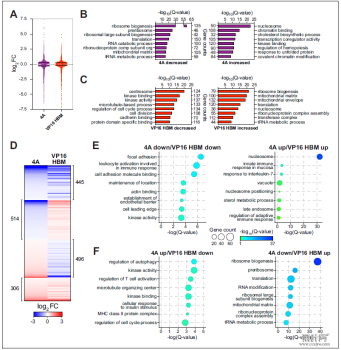
MYC-HCF-1相互作用影响核糖体物种发生和线粒体途径中涉及的基因的表达
此外,研究人员还发现,MYC与HCF-1的相互作用并不会影响这两种蛋白质结合其染色质结合位点的能力。由于MYC调节核糖体和线粒体物种发生的能力是其致瘤性的核心,因此研究人员推测破坏其与HCF-1的互作可能会影响BL细胞体内建立和维持肿瘤的能力。通过测试4A MYC突变体小鼠成纤维细胞肿瘤发生的状况,研究人员发现MYC与HCF-1的相互作用对于维持肿瘤至关主要,伴随着高水平的细胞凋亡,4A突变导致的互作破坏也促使了小鼠的肿瘤迅速而持续的消逝,存活率极大提升。
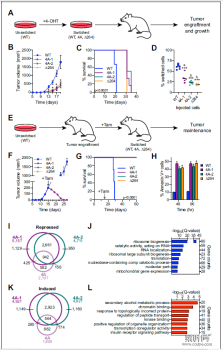
肿瘤植入和维持需要MYC-HCF-1相互作用
研究人员表示,目前该研究在小鼠实验中表现出了令人兴奋的疗效,但距离应用于人体癌症的医治还要很长的一段路要走。
参考资料:
https://elifesciences.org/articles/60191
声明:本文内容仅代表作者个人观点,与本站立场无关。如有内容侵犯您的合法权益,请及时与我们联系,我们将第一时间安排处理。更多精彩内容请关注红叶网
-

-

-
-

-

-
-

-

-
-
-

-
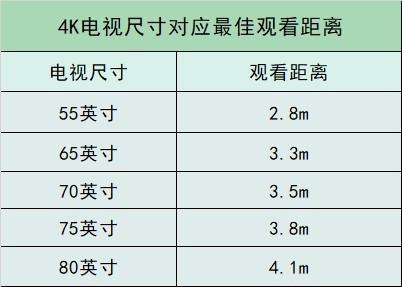
 大学生买什么笔记本电脑好 前沿科技0人阅读
大学生买什么笔记本电脑好 前沿科技0人阅读 -
-

-
-
 麝香是什么动物身上的哪个部位,雄麝的腺囊的分泌物 前沿科技110人阅读
麝香是什么动物身上的哪个部位,雄麝的腺囊的分泌物 前沿科技110人阅读 -
 石楠花为何叫最污花,因其花香特别像男子的精液一样 前沿科技102人阅读
石楠花为何叫最污花,因其花香特别像男子的精液一样 前沿科技102人阅读 -

-

-
-

-
-

-
 前苏联科学家成功让断开的狗头张嘴复活数小时 前沿科技101人阅读
前苏联科学家成功让断开的狗头张嘴复活数小时 前沿科技101人阅读 -
 暗物质实验发出的信号可能预示着新的物理学原理 前沿科技100人阅读
暗物质实验发出的信号可能预示着新的物理学原理 前沿科技100人阅读 -

-

-
 SpaceX的龙飞船长什么样? 前沿科技100人阅读
SpaceX的龙飞船长什么样? 前沿科技100人阅读